|
重要
113學年度 碩士在職專班 面試時間表
|
2024-04-23 |
|
重要
熱門
113學年度申請入學甄審說明會
|
2024-03-27 |
|
重要
熱門
亞洲大學「台中市豐原區豐富專案」2日完成簽約,拚2028年營運服務
|
2024-03-11 |
|
重要
熱門
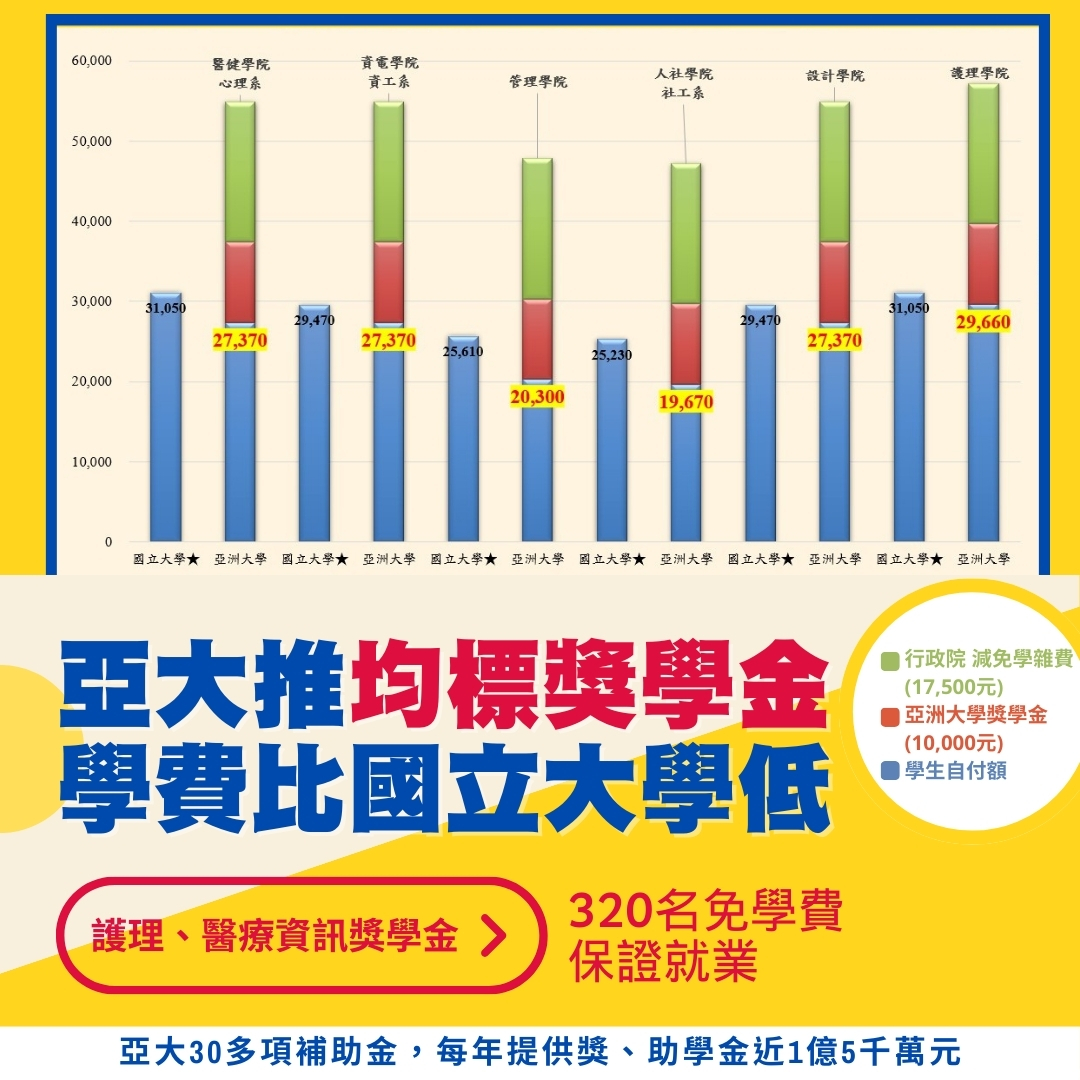
選私不選公!亞大推出「均標獎學金」,學雜費比國立大學還低!
|
2024-03-11 |
|
重要
熱門
113學年度博士班、碩士班、碩士在職專班入學招生訊息
|
2024-02-06 |
|
【教務處】112-2學期學生跨域學習(跨領域學程必修、他系專長學程等)期末成績登錄方式申請
|
2024-04-25 |
|
【語發中心】113年英語文先修營(Pre-Arrival Program)
|
2024-04-13 |
|
【教務處】112-2學期「停修」申請資訊
|
2024-04-12 |
|
【國際事務處】 AU Break Away 一般寒暑假出國交換學習
|
2024-03-22 |
|
112學年度第2學期_健管系外系學生選課申請表單
|
2024-02-16 |
|
【教務處 】112-2學期 開學課程加退選及超修申請公告(含今年寒假寒轉二、三年級新生)
|
2024-02-16 |
|
【重大公告】Microsoft 365教育版將進行儲存空間變更,敬請協助通知校友盡快於113年2月1日前備份下載資料
|
2024-01-30 |
|
2024亞洲大學健康產業管理學系系友回娘家
|
2024-01-15 |
|
【教務處】112學年度第1學期畢業資格審查、離校程序與學位證書領取公告
|
2024-01-11 |
|
【教務處】112-2學期新生、轉系生「學分抵免」申請
|
2023-12-29 |
|
【教務處】112-2 學期至「中國醫藥大學」國內交換生申請公告
|
2023-12-21 |
|
【教務處】112-2 學期課程預選公告(2023-2nd Semester Course Pre-Selection)
|
2023-12-20 |
|
2024健管系寒假營隊
|
2023-12-07 |
|
【生涯組】110學年度畢業生畢業後一年流向調查
|
2023-12-06 |
|
2024公衛高峰論壇
|
2024-04-15 |
|
長照青潮湧起來~全國健康照護服務形象創意影片競賽
|
2024-03-22 |
|
113年醫務行政管理人員證照考試
|
2024-03-19 |
|
113年PFPS病人安全民眾代表培訓班─初級班(兩日課程)
|
2024-03-18 |
|
行天宮醫療志業醫療財團法人恩主公醫院112學年度第二學期「長照人才培育獎助學金」
|
2024-03-13 |
|
2024年 第30屆 「公共衛生優秀論文獎──陳拱北教授紀念獎」徵選開跑!
|
2024-03-05 |
|
擁抱失智·心生活一2024大專校院失智症方案設計及執行競賽
|
2024-01-24 |
|
國立中正大學113年度新加坡南洋理工大學寒假遊學學分班
|
2023-12-05 |
|
國立中正大學113年度日本東北大學寒假遊學學分班海報及活動簡章相關資訊
|
2023-11-23 |
|
選育計畫「ColleGo!焦點話題限時擴大徵稿活動」
|
2023-11-22 |
|
財團法人國家衛生研究院高齡醫學暨健康福祉研究中心於112年12月辦理2場研討會
|
2023-11-13 |
|
國立陽明交通大學健康長壽與老化科學研究中心112年12月2日(六)辦理「高齡科技創新高峰論壇」
|
2023-11-07 |
|
長照實務與醫療管理人才培育論壇
|
2023-10-26 |
|
環境部2023空品科普競賽
|
2023-10-25 |
|
112年能源公益參與式預算說明會
|
2023-10-20 |
|
社團法人中華民國應用商業管理協會『銀髮族團康遊戲設計』實體研習暨證照檢定密集輔導班
|
2023-10-13 |
|
2023年10月22日辦”全球衛生韌性與治理”青年工作坊
|
2023-10-13 |
|
2023全國銀髮族創意餐食能力競賽
|
2023-09-15 |
|
第十二屆全人醫療暨整合服務研討會暨國際論壇
|
2023-09-06 |
|
南投縣政府衛生局徵才
|
2024-04-12 |
|
誠徵亞洲大學附屬醫院醫務行政室事務員
|
2024-03-27 |
|
社團法人高雄市濟興護老慈善會徵才
|
2024-03-04 |
|
誠徵亞洲大學附屬醫院醫療品質部 事務員(組員)/助理管理師1030220
|
2024-02-20 |
|
國民健康署碩士級約用專業人員職缺1130112
|
2024-01-12 |
|
臺北市政府衛生局徵才訊息1130110
|
2024-01-10 |
|
國民健康署委託計畫徵求研究助理駐點人員【學士級】1名
|
2023-12-29 |
|
臺北市立萬芳醫院徵研究部事務員
|
2023-12-08 |
|
大里仁愛醫院經營管理組徵行政管理師
|
2023-11-23 |
|
亞洲大學附屬醫院 外科部 個案管理師1121117
|
2023-11-17 |
|
國民健康署碩士級約用專業人員職缺1120914
|
2023-09-14 |
|
國民健康署碩士級約用專業人員職缺
|
2023-08-29 |
|
國民健康署監測研究及健康教育組公告碩士級約用專業人員職缺1120801
|
2023-08-02 |
|
光田體系 醫養合作 歡迎 熱血專業人才1120801
|
2023-08-01 |
|
北醫大管顧附設杏芳.萂禾.君蔚居家長照機構
|
2023-07-26 |
|
國健署監測組徵才資訊
|
2023-07-03 |
|
中國醫藥大學附設醫院台中東區分院 徵才
|
2023-07-03 |
|
仁愛醫療財團法人大里仁愛醫院徵行政管理師
|
2023-06-08 |
|
彰化基督教醫療財團法人彰化基督教醫院-教學部教師培育中心管理師徵才訊息
|
2023-05-31 |
|
【亞大健管專欄】創新潔牙技術於護理之家:提升照護服務的品質新猷
|
2024-02-29 |
|
【亞大健管專欄】應用新型態遠距互動 對抗高齡孤獨感
|
2023-12-26 |
|
【亞大健管專欄】照服員又離職?離職原因大攤牌,雇主準備好了嗎?
|
2023-07-31 |
|
【亞大健管專欄】怎麼教長輩維持口腔健康?融入易讀通用設計 衛教更有效
|
2023-06-13 |
|
【亞大健管專欄】死亡風險高 加強重視年輕失智者交通安全議題
|
2023-04-11 |
|
【亞大健管專欄】疫情下,樂齡族也夯線上學習?樂齡學習新模式
|
2023-02-09 |
|
【亞大健管專欄】「想見你!」疫後熟齡用智慧手機科技遇見幸福
|
2022-10-28 |
|
【亞大健管專欄】這禮拜有要回家吃晚飯嗎?吞噬高齡者的隱形殺手-孤獨感
|
2022-09-27 |